私が血液の酸塩基平衡に特別に関心をもつようになったのは、和歌山県立医科大学で生化学の講義を担当していたときのことです。臨床医学を目指す学生に基礎医学の重要性を認識してもらうために、第一回目の講義を麻酔科学の先生に頼みました。その講義の内容が「血液の酸塩基平衡」でした。そのときの講義プリントを参考にし、生理学や生化学の教科書も参照しながら説明を進めます。きっと、これまでのブログの記事を理解するのに役に立つと思います。
水1 L(水のpHは 7.0)に 1Nの塩酸を1ml 加えると、pHは3.0になります。しかし、血液1 L (血液のpHは7.4))に 1 Nの塩酸を1ml 加えたときは、pHは7.37にしか低下しません。pHがほとんど低下しないのは、血液には色々な緩衝物質が存在し、これがH+を結合してしまうからです。この反応は速やかで、秒単位です。緩衝物質として、HCO3-が生理学的には非常に重要です。それは、HCO3-の血漿濃度がpH変化に応じて生理的に調節を受けるからです。
炭酸・重炭酸塩緩衝系の酸塩基平衡の化学式は、
CO2 + H2O ⇌ H2CO3 ⇌ H+ + HCO3-
と表され、溶存CO2(ガスとして溶けているCO2とH2CO3の和)を酸と考えた場合、次の関係式が成り立ちます。
pH = 6.1 + log10 ([HCO3-]/[溶存CO2])・・・・・式5-1
ヒトの動脈血では、([HCO3-] = 24 mEq/L、[溶存CO2] = 1.2 mEq/Lですので、pH = 7.4となります。このように血液のpHは、溶存CO2濃度とHCO3-濃度の比によって決まります。血液ガス分析では、動脈血の炭酸ガス分圧(PaCO2)を測定して、[溶存 CO2] = 0.03 ×PaCO2という関係から[溶存CO2]を求めます。PaCO2 = 40 mmHgなので、[溶存CO2] は0.03 × 40 = 1.2 mEq/Lとなります。
ヒトの動脈血では、([HCO3-] = 24 mEq/L、[溶存CO2] = 1.2 mEq/Lですので、pH = 7.4となります。このように血液のpHは、溶存CO2濃度とHCO3-濃度の比によって決まります。血液ガス分析では、動脈血の炭酸ガス分圧(PaCO2)を測定して、[溶存 CO2] = 0.03 ×PaCO2という関係から[溶存CO2]を求めます。PaCO2 = 40 mmHgなので、[溶存CO2] は0.03 × 40 = 1.2 mEq/Lとなります。
全身の組織でグルコースや脂肪が代謝されると、CO2とH2Oが生成します。CO2は気体でH2Oと反応して炭酸(H2CO3)になるため、揮発性酸と呼ばれ、その産生量は15,000 mEq/日にもなります。このように産生されたCO2がどのように処理されるかを図4に示します。そのうち約90%のCO2はH2Oと反応してH2CO3となります。この反応は遅いですが、体内ではCO2は組織の毛細血管の赤血球に取り込まれ、炭酸脱水酵素の働きで速やかに進行します。H2CO3はさらに、H+とHCO3-に解離します。この反応は速やかです。HCO3-は赤血球から血漿に出て、替わりにCl-が赤血球中に入ります。一方、H+ はヘモグロビンと結合します。そして、血液が肺に運ばれると、今述べた反応が逆に進行し、CO2が再生されて肺 から排出されます。
麻酔科学の先生の講義には、次のようなひとコマがありました。先生は、パルスオキシメーター(指先にセンサーを付けて動脈血の酸素飽和度を測定する機器)を持参されました。学生の一人が被験者となり、酸素飽和度の測定をすると100%近くの値でした。先生は次にできるだけ息を長くこらえるように頼みました。そこで質問です。息をこらえたあとの測定値はどうなるでしょう。結果は、酸素飽和度はほとんど変化しません。息が苦しくなるのは何故でしょう。答えは、血液中のCO2濃度が高くなるためです。すると、延髄や血管壁の化学受容体がCO2濃度の増加を感知して呼吸が促進され、体内にたまったCO2が肺から排出されます。このような応答は分単位で起きます。
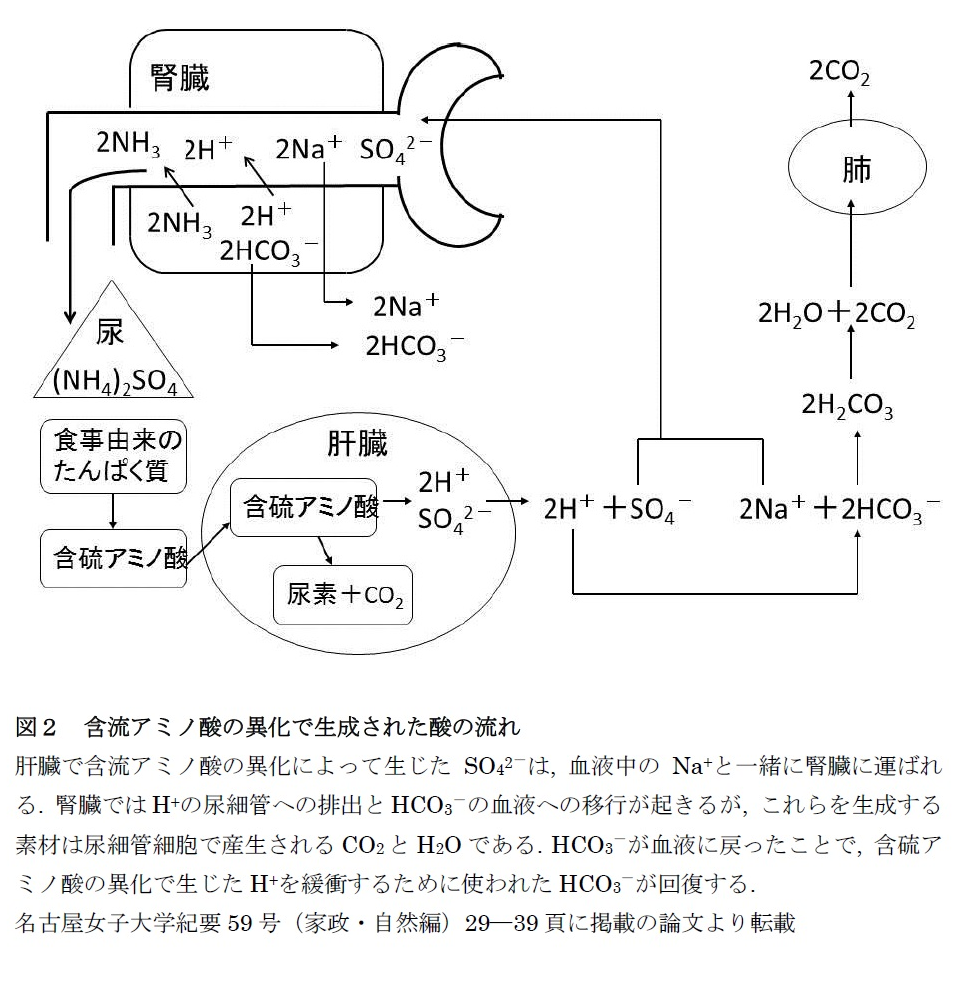
体内ではCO2以外に、不揮発性酸とよばれる酸性物質が、代謝の結果生成します。たんぱく質由来の硫酸や核酸由来の尿酸の他、激しい運動時に生成する糖質由来のピルビン酸や乳酸、絶食時に生成する脂質由来のケトン体(アセト酢酸 とβヒドロキシ酪酸)などがあります。不揮発性酸は一日に40 mEq産生され、腎臓から排出されます。これらの物質が組織の代謝で生成するときには、H+が遊離します。H+とHCO3- の反応によって生成するH2CO3は、赤血球中で炭酸脱水酵素の作用によって CO2 とH2Oに分解され、CO2 は肺から排出されます。この過程で失われたHCO3-を補充するのは腎臓の役割です。尿細管細胞でCO2 とH2OからH2CO3 ができ、さらにH+とHCO3-が生成されます。このときにも炭酸脱水酵素が働きます。この新しく作られたHCO3-が血液に移行し、尿細管腔にはH+が排出されます。H+は、尿中に排出される緩衝物質であるリン酸塩、クレアチニン、尿酸などに結合します。このうち、尿への排出量が比較的多く、尿のpH(6.5付近)で緩衝作用の強いリン酸塩が重要です。さらに、尿細管細胞でグルタミンからつくられるNH3も、H+を受け取る重要な物質です。上記の不揮発性酸は陰イオンなのでNa+と一緒に腎臓に運ばれ、糸球体でろ過されます。先に尿細管腔にH+が排出されることを述べましたが、その排出と同時にNa+が尿細管腔から血中に戻るので、全体の陰陽のイオンバランスが保たれます。含硫アミノ酸の代謝によって生じる硫酸の場合ついて、「酸性食品・アルカリ性食品」再考(その4)の図2で説明してあります。
体液に酸塩基負荷をもたらす過程がもう一つあります。(その4)で説明した腸管における陰イオンと陽イオンの吸収率の差によるものです。腸管から血液に取り込まれた陰イオンが過剰のときには、その分に相当するHCO3-が、血液から失われて便の中に失われます。塩基であるHCO3-が減るので酸負荷が起きるわけです。CaCl2の腸管吸収の例を(その4)の図3で説明しました。
ここまでの説明は、食事性の酸塩基負荷を理解するのに必要な生理学的事柄でしたが、管理栄養士国家試験でよく出題されるアシドーシス・アルカローシスについて一言述べておきます。呼吸性と代謝性 に分類されますが、これまでの説明を踏まえると理解が容易になります。ポイントは、式5-1です。まず、呼吸性の病態を見てみましょう。このときは呼吸によるCO2の排出のようすが問題になります。肺胞での換気が障害されると動脈血にCO2が増加するのでとpHが低くなります。このことは式5-1から分かりますね。これが呼吸性アシドーシスです。逆に、動脈血のCO2が減少するとpHが高くなり、呼吸性アルカローシスが起きます。過呼吸の場合です。 代謝性の病態では、動脈血の HCO3-の増減が問題となります。下痢のためにNaHCO3が失われると, 動脈血の NaHCO3が減少するのでpHが低くなります(代謝性アシドーシス)。 このことも式5-1から分かりますね。 逆に、嘔吐の場合には、HClが失われるので血液中のCl- が減少する替わりにHCO3-が増加します。したがって、血液のpHが高くなります(代謝性アルカローシス)。
今回は、式5-1が重要でした。この式と関連した話しで終わりにします。私は大学院生のとき酵素の研究をしたので、緩衝液はその頃から馴染みのものでした。ここからは化学の話しです。弱酸AHが塩基A-とH+に解離する反応の平衡を考えます。
AH ⇌ A- + H+
この反応の解離定数 Ka は解離のしやすさを示す定数で、次の式で表されます。
Ka=
[H+] [A-] / [AH]
両辺の常用対数を取って負号つけると、
‐logKa =‐log [H+] - log([A-]/[AH])
定義によってpH = -log[H+]で、‐logKaをpKaと表わすと、次のように式を変形できます。
pH =
pKa + log([A-]/[AH])・・・・式5-2
この式はヘンダーソン-ハッセルベルヒの式と呼ばれ、pHと酸・塩基それぞれの濃度との関係を表します。炭酸・重炭酸塩緩衝系の場合は、pKa =
6.1のため前に示した式5-1のようになります。式だけでは分かりにくいので、式5-2をグラフにしてみましょう。
pHとAHの解離度(AH全体のどれだけが解離しているかの割合)との関係をグラフで表してみます。解離度α = [A-]/([A-] +
[AH])ですから、1-α =
[AH]/([A-] + [AH])となります。したがって、式5-2は、次のように表すことができます。
pH =
pKa + log{α/(1-α) }・・・・式5-3
Excelで、炭酸・重炭酸塩緩衝系(pKa = 6.1)の場合の、pHとαの関係のグラフを作成してみましょう。セルA1~A21にα の値として0.01, 0.05, 0.1, 0.15, 0.2,
0.25, 0.3, 0.35, 0.4, 0.45, 0.5, 0.55, 0.6, 0.65, 0.7, 0.75, 0.8, 0.85, 0.9,
0.95, 0.99を入力し、セルB1にfx=6.1+LOG($A1,10)-LOG(1-$A1,10)の値を計算させます。セルB21までの値を計算したのち、セルA1~A21を横軸、セルB1~B21を縦軸にして散布図を作成すると、図5のグラフが得られます。私が大学生だった頃(1960年代)、電卓が出回り始めました。その当時はα/(1-α) を計算し、対数表を使って対数に変換してpHの値を求めてグラフを作ったのを思い出します。図5の表の値を用いてグラフ用紙に一点一点プロットしていくと、滴定をしている感じがつかめます。ところで、グラフから分かるように、pH =
6.1 のところで,αの変化に対しpH の変化が最小になります。つまり、緩衝作用が最高になるのは、pHがpKaの値になる点です。炭酸・重炭酸塩緩衝系は、血液のpH 7.4では、pKa の値からかなり離れるので緩衝能があまり高くないけれど、 HCO3-の濃度が高いので緩衝作用を発揮します。
(その3)に、pH 7.4でリン酸のイオンの価数を形式的に-1.8であると説明しました。今説明したpHと弱酸の解離度との関係が理解できると、このことが簡単に分かります(図6)。次の反応を考えましょう。
H2PO4‐⇌ HPO42‐ + H+
この解離平衡のpKaは6.8なので、式5―3を使うと、7.4 = 6.8 + log{α/(1-α) } となり、log{α/(1-α) }= 0.6 です。対数表を見てみると、対数が0.6となるのは0.3981ですから、4としましょう。そうすると α/(1-α) = 4 となり、HPO42‐の割合は α = 4/5 = 0.8 になります。残るH2PO4‐の割合は0.2ですから、形式的な価数は2 × 0.8 + 1 × 0.2 =1.8となります。納得できましたでしょうか。
参考図書
1)R. Montgomery, R. L. Dryer,
T. W. Conway, and A. A. Spector, “Biochemistry: A case-oriented approach
(Second edition)”, The CV Mosby Company, St Louis, 1980.
酸塩基平衡に関する4章を参考にしました。
2)W. F. ボロン/E. L. ブールペープ 編「カラー版 ボロン ブールペープ 生理学」 (泉井 亮 総監訳、 河南 洋、久保川学 監訳)、西村書店、東京、 2011
「38章 酸と塩基の輸送」を参考にしました。
酸塩基平衡にまつわる私の感慨を込めながら、今回の記事を書きました。
無断転載禁止